Preservación de la Fertilidad
Efectos en la fertilidad de los tratamientos contra el cáncer
Uno de los principales efectos adversos asociados a los tratamientos oncológicos son los relacionados con el área reproductiva. Los efectos de los tratamientos contra el cáncer en la fertilidad de la mujer dependen, entre otros factores, de la edad, la reserva ovárica en el momento del diagnóstico de cáncer, así como del tipo de cáncer y el tipo de tratamiento que se haya seguido. Por tanto, es difícil saber con certeza cómo se verá afectada la fertilidad de la mujer, ya que incluso puede ser posible que no todas las mujeres que reciben tratamiento contra el cáncer desarrollen un problema de fertilidad en el futuro.

- 1. Efectos en la fertilidad de los tratamientos contra el cáncer
- 1.1 Toxicidad de algunos medicamentos usados en los tratamientos contra el cáncer
- - Quimioterapia
- - Radioterapia
- - Cirugía
- - Terapia hormonal
- - Anticuerpos monoclonales
- - Cuadro resumen sobre el efecto de los tratamientos oncológicos sobre la fertilidad
- 1.2 ¿Qué es la reserva ovárica?
- - ¿Cuáles son los factores que pueden llevar a una baja reserva ovárica?
- - ¿Qué consecuencias puede tener una baja reserva ovárica?
Efectos en la fertilidad de los tratamientos contra el cáncer
Uno de los principales efectos adversos asociados a los tratamientos oncológicos son los relacionados con el área reproductiva. Los efectos de los tratamientos contra el cáncer en la fertilidad de la mujer dependen, entre otros factores, de la edad, la reserva ovárica en el momento del diagnóstico de cáncer, así como del tipo de cáncer y el tipo de tratamiento que se haya seguido. Por tanto, es difícil saber con certeza cómo se verá afectada la fertilidad de la mujer, ya que incluso puede ser posible que no todas las mujeres que reciben tratamiento contra el cáncer desarrollen un problema de fertilidad en el futuro.
Toxicidad de algunos medicamentos usados en los tratamientos contra el cáncer
Los tratamientos médicos más utilizados en el manejo multidisciplinario del cáncer de mama son la quimioterapia, la radioterapia, la cirugía, la terapia hormonal y los anticuerpos monoclonales. Dado que cada uno funciona de diferente manera, es importante comprender cada uno y aclarar posibles dudas con el profesional sanitario a cargo de su tratamiento.
Quimioterapia
Es el uso de determinados fármacos para destruir o ralentizar el crecimiento de células cancerosas. A menudo tiene efectos adversos sobre las células sanas del cuerpo y por tanto puede dañar los ovarios y disminuir la cantidad de óvulos, afectando la fertilidad de la mujer.
El efecto de la quimioterapia sobre la fertilidad depende fundamentalmente de:
- El tipo de medicamentos que se van a administrar.
- La dosis y el tiempo que tendrá que usarlos. De manera frecuente, las dosis más altas y por un tiempo prolongado ocasionan mayores efectos adversos sobre la fertilidad.
- La combinación de medicamentos que le darán.
- Su edad y estado de fertilidad o reserva ovárica anterior. La premisa es que a mayor edad la reserva ovárica será menor.
Los agentes alquilantes, como la ciclofosfamida, son los más tóxicos y son los principales causantes de la menopausia inducida por quimioterapia en el cáncer de mama.
Radioterapia
La radioterapia funciona mediante el uso de rayos de alta energía (generalmente rayos X) para destruir las células cancerosas en el área específica que se está tratando. Se puede administrar externamente, a través de una máquina que dirige rayos X (los cuales no son visibles) hacia el cuerpo. La manera que la radioterapia afecta la fertilidad va a depender de la proximidad de los rayos a los ovarios, o al útero. Si la radiación se recibe a menor distancia aumentará la dosis de radiación en estos órganos y el riesgo de alteraciones de la fertilidad. Por el contrario, si la radiación se recibe en zonas más alejadas como es el caso de la mama, no existe riesgo de alteración de la fertilidad.
- Altas dosis de radioterapia en los ovarios pueden destruir los ovocitos restantes y producir como resultado insuficiencia ovárica prematura o menopausia precoz.
- La radioterapia que afecta al útero podría causar futuros abortos espontáneos, nacimientos prematuros y bebés con bajo peso al nacer.
Cirugía
La cirugía funciona retirando las células cancerígenas del cuerpo mediante una operación. A veces, este procedimiento significa extraer la parte del cuerpo en la que ha crecido el cáncer/tumor, por ejemplo, la mama en el caso del cáncer de mama. Las mujeres que necesitan cirugía para tratar un cáncer que afecta a los ovarios, el cuello uterino o el útero pueden enfrentar problemas con su fertilidad. Por tanto, el efecto de la operación sobre la fertilidad depende del tipo de cáncer que tenga y de si se ha llegado a irradiar a órganos implicados en la reproducción (i.e. ovarios, útero).
Terapia hormonal
Se refiere a medicamentos que se usan para cambiar el funcionamiento de las hormonas en el cuerpo. Se administra para ayudar a reducir la posibilidad de que el cáncer reaparezca, así como para tratar un cáncer que ha vuelto después del tratamiento o que ya se ha diseminado.
La terapia hormonal se administra a mujeres con cánceres que dependen de la acción de las hormonas, especialmente de los estrógenos y que suponen el 70% de los cánceres de mama. También se conocen como hormonodependientes, hormonosensibles o luminales.
En las pacientes con un cáncer de mama hormonodependiente se busca retrasar o detener el crecimiento del cáncer, ya sea: a) reduciendo los niveles de hormonas en su cuerpo, o b) disminuyendo la capacidad de crecimiento de las células cancerosas. La terapia hormonal se usa principalmente en el cáncer de mama durante un largo período de tiempo, entre 5 y 10 años.
Algunas terapias hormonales comunes se basan en el uso de medicamentos como el Tamoxifeno, Goserelina (Zoladex) o Leuprorelina (Prostap), Anastrozol (Arimidex), Letrozol (Femara) y Exemestano (Aromasina).
El uso de estas hormonas puede hacer que el periodo menstrual sea irregular o se detenga, puede ser que aparezca de nuevo unos meses después de suspender el tratamiento, siempre y cuando no haya llegado la menopausia de manera natural.
Si parte de su tratamiento incluye terapia hormonal, se le recomendará no quedarse embarazada durante el tratamiento y durante un tiempo después. Sin embargo, algunas mujeres toman la decisión, junto a su profesional sanitario, de parar su terapia hormonal para tener un bebé. En todos los casos se recomienda analizar cada caso con el profesional sanitario a cargo del tratamiento.
Anticuerpos monoclonales
Los anticuerpos monoclonales son unas partículas que se unen a las células cancerosas para evitar que éstas crezcan. El Trastuzumab y el Pertuzumab son dos anticuerpos monoclonales que se usan frecuentemente para tratar a algunas mujeres con cáncer de mama. No hay información concluyente sobre sus efectos sobre el sistema reproductivo y el bebé en desarrollo. Si parte de su tratamiento implica una terapia de este tipo, se le recomendará que no quede embarazada durante el tratamiento contra el cáncer y durante un tiempo después.
Efecto de los tratamientos oncológicos sobre la fertilidad
| Tratamientos | ¿Afectará este tratamiento a mi fertilidad? |
| Quimioterapia | Posiblemente. La ciclofosfamida es un medicamento que puede afectar su fertilidad. Por lo general, se administra en combinación con otros medicamentos durante la quimioterapia. |
| Radiación | No. A menos que la radiación afecte la zona de los ovarios, lo cual afectaría su fertilidad. |
| Cirugía | No. A menos que sea necesario someterse a una cirugía para extraerle los ovarios, lo cual afectaría su fertilidad. |
| Terapia hormonal | Posiblemente. Si su cáncer es sensible a las hormonas, podría estar tomando hormonas durante 5 años o más. Esto retrasará su capacidad de quedar embarazada, ya que no es recomendable quedarse embarazada durante este tratamiento. |
| Anticuerpos monoclonales | Se desconoce. En este caso puede estar tomando Trastuzumab durante aproximadamente un año. No hay información concluyente sobre el impacto de este medicamento en la capacidad reproductora. |
¿Qué es la reserva ovárica?
La reserva ovárica es el número total de óvulos que una mujer tiene en sus ovarios. Esta disminuye a medida que aumenta la edad, de manera que a mayor edad existe una menor reserva ovárica y una menor calidad de los óvulos. Las mujeres no producen óvulos a lo largo de su vida reproductiva, sino que nacen con un número determinado de ellos, y a lo largo de la edad reproductiva, éstos maduran, uno en cada ciclo menstrual, de manera que a medida que pasan los años, se van agotando, y de aquí a que se diga que ¨la reserva ovárica disminuye con la edad¨.
Hay una serie de pruebas que se pueden realizar para determinar la reserva ovárica; una de ellas es el recuento de los folículos antrales (ovocitos madurando hacia óvulos), procedimiento sencillo que se puede realizar a través de una ecografía vaginal. Si en cada ovario se computan entre 5 y 10 folículos, se considera que la reserva ovárica es óptima. Pero si está por debajo de 5, las probabilidades de tener un embarazo natural se verán reducidas.
Como prueba adicional, se puede analizar la hormona antimülleriana, que proporciona información sobre la cantidad de folículos ováricos. Esta hormona es producida por los folículos de pequeño tamaño en los ovarios y es un indicador proporcional del número de óvulos disponibles que presenta la mujer a cada edad. A menor cantidad de hormona antimüleriana, menor probabilidad de embarazo.
¿Cuáles son los factores que pueden llevar a una baja reserva ovárica?
- La edad es el principal factor de riesgo para la pérdida de óvulos. A medida que pasan los años, el número de éstos va disminuyendo, y los que quedan van acumulando mutaciones, pues tienen la edad fisiológica de la mujer ya que la mujer nace con ellos, no los forma a lo largo de su vida (a diferencia de los hombres que forman espermatozoides nuevos a lo largo de toda su vida).
- Además, la pérdida de óvulos se puede acelerar en diversas circunstancias:
- Si se han operado los ovarios.
- Si se ha recibido quimioterapia y/o radioterapia.
- Si se han padecido enfermedades como la endometriosis o enfermedades autoinmunes.
- Si existen antecedentes familiares de menopausia precoz o enfermedades genéticas que puedan alterar el funcionamiento del ovario.
- Otras causas desconocidas.
¿Qué consecuencias puede tener una baja reserva ovárica?
La principal consecuencia que puede tener la baja reserva ovárica es que disminuye la posibilidad de conseguir un embarazo incluso con ayuda de las técnicas de reproducción asistida, ya que el éxito de los tratamientos de reproducción depende de obtener un número suficiente de óvulos y de la calidad de los mismos.
- 2. La fertilidad en las pacientes de cáncer de mama
- 2.1 No seguir un tratamiento de PF, sólo una espera vigilada
- 2.2 Procedimientos de Preservación de la Fertilidad
- - Fases del proceso
- - ¿Qué mujeres se podrían beneficiar de estos procedimientos?
- - Eficacia de los procedimientos de PF
- - Seguridad de los procedimientos de PF
La fertilidad en las pacientes de cáncer de mama
De acuerdo con las guías de práctica clínica actuales, se recomienda que las distintas opciones para preservar la fertilidad a las mujeres con cáncer de mama sean discutidas entre profesionales y pacientes, lo antes posible a partir del momento del diagnóstico. Las consultas sobre fertilidad deberán estar disponibles para todas las mujeres que deseen preservar su fertilidad y también para aquellas que se muestren ambivalentes.
A continuación, se presentan las distintas opciones de preservación de la fertilidad (PF) a las que pueden acceder las mujeres con cáncer de mama antes de iniciar el tratamiento oncológico.
No seguir un tratamiento de PF, sólo una espera vigilada
No todas las mujeres con un diagnóstico de cáncer de mama querrán o podrán acceder a un procedimiento de preservación de la fertilidad antes del inicio del tratamiento oncológico. En estos casos existe la opción de una espera vigilada, es decir, de iniciar el tratamiento para el cáncer sin realizar previamente un procedimiento de preservación de la fertilidad. En el futuro, si lo desean, estas mujeres podrán intentar quedarse embarazadas de forma natural o recurrir a otras formas de maternidad.
Fases del proceso
Esta opción no requiere de ningún paso adicional, se iniciará el tratamiento oncológico sin realizar previamente un procedimiento de preservación de la fertilidad.
¿Qué mujeres se podrían beneficiar de esta opción?
- Mujeres que prefieren seguir una espera vigilada de su fertilidad y ver si ésta regresa naturalmente después del tratamiento contra el cáncer.
- Mujeres con o sin hijos que consideran que ya tienen su familia establecida.
- Mujeres que están seguras de que no desean tener un embarazo después del tratamiento del cáncer.
- Mujeres con un cáncer de rápido crecimiento y necesitan comenzar el tratamiento de inmediato.
- Mujeres que prefieren no acceder a procedimientos de preservación de la fertilidad por cuestiones culturales, religiosas, familiares o personales.
- Mujeres que no tienen opciones de preservación de fertilidad disponibles para ellas porque no están disponibles en su región.
Eficacia de los procedimientos de PF
La posibilidad de tener hijos en el futuro depende de la edad y de cómo sus ovarios se hayan visto afectados por el tratamiento contra el cáncer que se haya seguido. Algunas mujeres pueden llegar a quedar embarazadas de forma natural después del tratamiento del cáncer sin seguir ningún método de preservación de la fertilidad. Si el tratamiento oncológico causa la menopausia, entonces es poco probable que ocurra un embarazo natural.
Seguridad de los procedimientos de PF
El mayor riesgo de no seguir un tratamiento de PF e iniciar una espera vigilada es la posibilidad de que el tratamiento oncológico afecte a la fertilidad de las mujeres con cáncer de mama, dificultando o incluso imposibilitando su capacidad para quedarse embarazadas en un futuro.
En general, se recomienda a las supervivientes de cáncer de mama que esperen al menos dos años tras finalizar el tratamiento antes de intentar quedarse embarazadas.
Antes de iniciar la planificación del futuro embarazo, además del tiempo, es importante que la paciente cuente con el alta oncológica correspondiente. Al no haber seguido ningún tratamiento de PF, no se espera ningún efecto sobre la recurrencia o la mortalidad.
Procedimientos de Preservación de la Fertilidad
De acuerdo con las guías de práctica clínica actuales, se recomienda que las distintas opciones para preservar la fertilidad a las mujeres con cáncer de mama sean discutidas entre profesionales y pacientes, lo antes posible a partir del momento del diagnóstico. Las consultas sobre fertilidad deberán estar disponibles para todas las mujeres que deseen preservar su fertilidad y también para aquellas que se muestren ambivalentes.
A continuación, se presentan las distintas opciones de preservación de la fertilidad (PF) a las que pueden acceder las mujeres con cáncer de mama antes de iniciar el tratamiento oncológico.
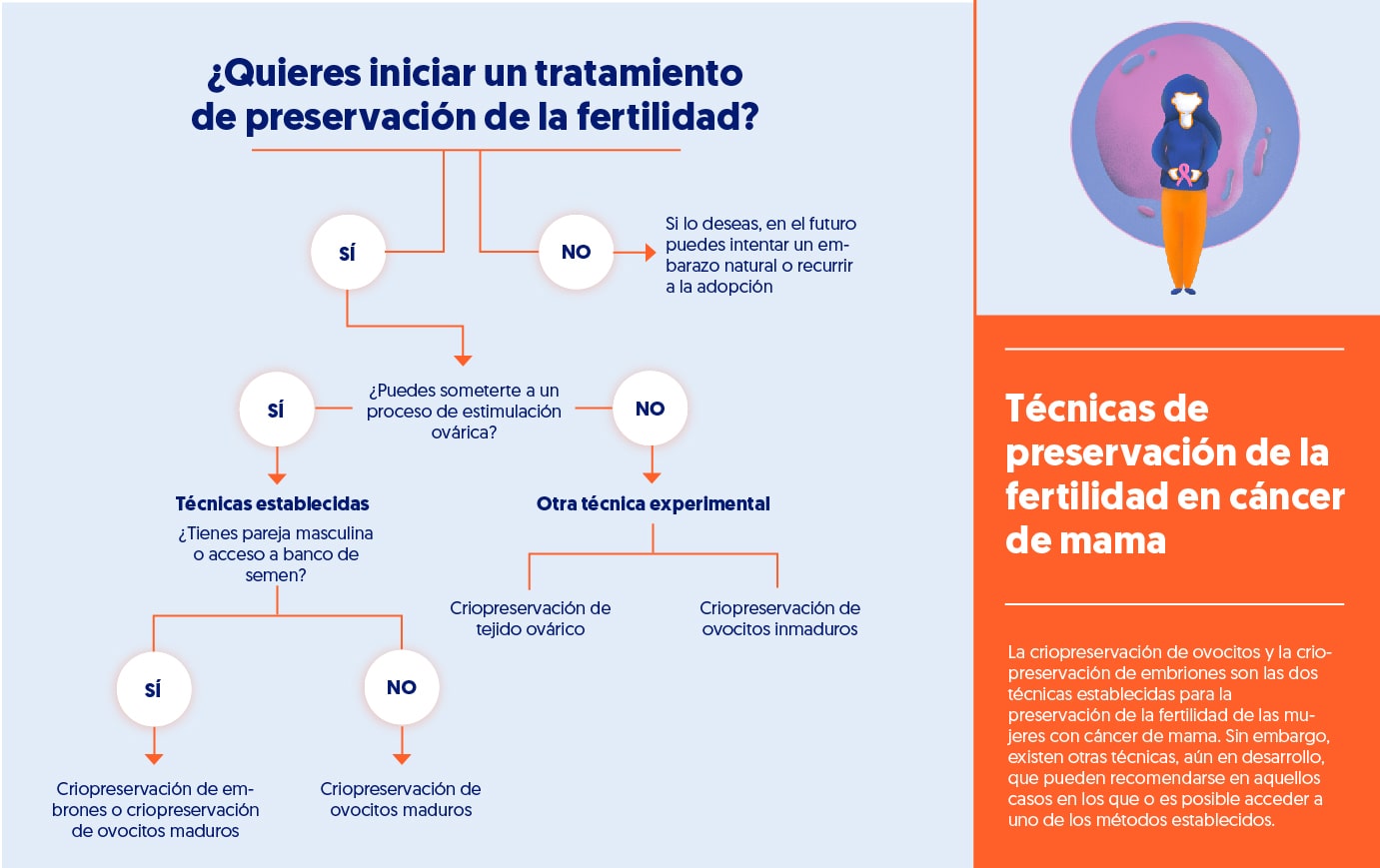
Métodos bien establecidos
Los dos procedimientos de PF aceptados e incorporados en la práctica clínica, son la criopreservación de ovocitos maduros y la criopreservación de embriones.
En qué consisten
La criopreservación de ovocitos maduros es un método establecido de PF que consiste en la conservación de los óvulos no fecundados tras someterlos a muy bajas temperaturas con el fin de mantener intactas sus propiedades hasta el momento de la descongelación y conservar el potencial reproductivo de la mujer. Requiere retrasar el tratamiento unas dos semanas. En algunos casos, la realización de este procedimiento implica que la paciente acuda a un centro especializado distinto de su centro de referencia.
La criopreservación de embriones se considera una técnica establecida y permite congelar óvulos fecundados a muy baja temperatura (-196ºC) para que puedan ser almacenados y conservados durante tiempo sin alterar su viabilidad. Implica la existencia de pareja o donante masculino y requiere retrasar el inicio del tratamiento oncológico unas dos semanas. En algunos casos, la realización de este procedimiento implica que la paciente acuda a un centro especializado distinto de su centro de referencia.
Fases del proceso
Algunas de las fases del proceso de criopreservación de ovocitos y embriones son compartidas. En la siguiente tabla se resume las fases de ambos procedimientos:
| Criopreservación de ovocitos maduros | Criopreservación de embriones |
| 1. Determinación de la reserva ovárica. Para determinar la cantidad y calidad de los óvulos es necesario estimar la reserva ovárica mediante pruebas bioquímicas y estudios ecográficos del ovario. Las pruebas de reserva ovárica ayudan a predecir el futuro reproductivo para individualizar las estrategias de preservación de la fertilidad antes de la quimioterapia. | |
| 2. Estimulación ovárica controlada. Generalmente se produce un único óvulo por ciclo menstrual; con la estimulación ovárica controlada se pretende conseguir mayor número de óvulos maduros disponibles en un solo ciclo ovárico. La duración de la estimulación ovárica depende de muchos factores, en especial de la respuesta de la mujer a la medicación hormonal. Tradicionalmente, el proceso de estimulación ovárica controlada requería de hasta seis semanas de tratamiento, sin embargo, en la actualidad existen protocolos que permiten acortar el proceso de estimulación ovárica a unas 2 semanas utilizando los protocolos tradicionales. | |
| 3. Punción ovárica para la extracción de óvulos. La aspiración de los óvulos maduros se practica bajo sedación-anestesia por vía transvaginal y con control ecográfico, siendo un procedimiento ambulatorio que no requiere ingreso alguno. | |
| 4. Fecundación in vitro (FIV) o inyección intracitoplasmática de espermatozoides (ICSI). En este punto se procede a la fecundación del óvulo por parte del espermatozoide. Esta unión puede hacerse principalmente siguiendo dos procedimientos: la fecundación in vitro tradicional (FIV), en la que se colocan en la misma placa de cultivo los óvulos y los espermatozoides esperando que éstos penetren en el óvulo, o bien mediante inyección intracitoplasmática (ICSI), en la que el espermatozoide se inyecta dentro del óvulo. | |
| 4. Congelación de óvulos. Una vez extraídos los óvulos maduros se procede a su criopreservación. Actualmente existen dos métodos principales para la criopreservación de óvulos: la congelación lenta, método que cada vez se usa menos, y la vitrificación, ampliamente utilizada en la actualidad por ofrecer mejores resultados. | 5. Congelación de embriones. Actualmente existen dos métodos principales para la criopreservación de embriones: la congelación lenta, método que cada vez se usa menos, y la vitrificación, ampliamente utilizada en la actualidad. Ambas hacen uso de crioprotectores, unas sustancias que protegen a los embriones sustituyendo el agua de su interior, pero existen ciertas diferencias entre ellas. En el método de congelación lenta, los embriones se enfrían en dos fases: una primera fase de congelación rápida para evitar la formación de cristales de hielo, y una segunda fase más gradual. Así, en un primer momento se procede a iniciar la congelación de los embriones a unos -2ºC/minuto hasta alcanzar aproximadamente los -7º. Posteriormente, se procede a enfriar aún más los embriones, a temperaturas de 0.3ºC/minuto hasta alcanzar temperaturas inferiores a -30ºC, momento en el que pasarán a almacenarse en nitrógeno líquido. En el método de vitrificación, los embriones están expuestos a mayores concentraciones de crioprotectores que pueden resultar perjudiciales para las células, por lo que el tiempo de exposición debe ser mínimo. En este caso, el descenso de la temperatura es mucho más rápido y los embriones se congelan de forma casi instantánea por inmersión en nitrógeno líquido a -196ºC. |
| 5. Descongelación o desvitrificación. Cuando la paciente solicite la recuperación de los óvulos congelados, todos los ovocitos criopreservados, o una parte de ellos serán sometidos a un proceso de descongelación o desvitrificación para ser posteriormente fertilizados con esperma de la pareja o de donante siguiendo un procedimiento de fecundación in vitro. | 6. Descongelación y desvitrificación. En el momento en que se desee proceder a la transferencia de los embriones al útero de la futura madre, se llevará a cabo su descongelación o desvitrificación. La descongelación o desvitrificación consiste en el proceso inverso a la congelación o vitrificación: las moléculas crioprotectoras se sustituyen de nuevo por agua intracelular recuperándose así la temperatura fisiológica. |
| 6. Fecundación in vitro (FIV) o inyección intracitoplasmática de espermatozoides (ICSI). En este punto se procede a la fusión de gametos, uniendo el óvulo y el espermatozoide, es decir, a la fecundación del óvulo. Esta unión puede hacerse siguiendo dos procedimientos, la fecundación in vitro tradicional (FIV), en la que se colocan en la misma placa de cultivo los óvulos y los espermatozoides esperando a que el espermatozoide entre dentro del óvulo o bien mediante inyección intracitoplasmática (ICSI), en la que el espermatozoide se deposita directamente en el interior de óvulo. Aunque tradicionalmente los protocolos incorporaban el uso de la FIV, en la actualidad el uso de la vitrificación hace necesario el empleo de ICSI. | |
| 7. Transferencia de embriones. La transferencia de embriones consiste en la colocación de los embriones en el fondo del útero materno mediante un catéter fino que se introduce por vía vaginal. Para asegurar la colocación de los embriones en el lugar adecuado, se hace de manera ecoguiada (guiada por ecógrafo). Se trata de un proceso que dura unos pocos minutos y que generalmente no requiere sedación. Previamente a la transferencia de embriones, y con el objetivo de garantizar una correcta implantación, es necesario administrar el tratamiento hormonal preciso para la preparación del endometrio mediante el uso de estradiol oral o mediante parches transdérmicos y progesterona micronizada por vía vaginal o inyectada. Antes de iniciar la planificación del futuro embarazo, además del tiempo, es importante que la paciente cuente con el alta oncológica correspondiente. | |
¿Qué mujeres se podrían beneficiar de estos procedimientos?
| Criopreservación de ovocitos maduros | Criopreservación de embriones |
|
|
Eficacia de los procedimientos de PF
A continuación, se presentan los datos de eficacia de la criopreservación de ovocitos maduros y la criopreservación de embriones:
Eficacia de la criopreservación de ovocitos maduros: La eficacia de este procedimiento se puede determinar por la probabilidad de tener un bebé después del procedimiento. Es difícil estar seguro de qué tan probable es que la congelación de óvulos resulte en el nacimiento de un bebé, ya que el número de mujeres con cáncer de mama que han usado sus óvulos congelados es pequeño. La mayoría de los datos provienen de mujeres sin cáncer que han usado sus propios óvulos congelados u óvulos de donantes para conseguir un embarazo. La posibilidad de tener un bebé, después de un procedimiento de criopreservación de ovocitos, está entre el 33 y el 50% para mujeres hasta los 35 años y del 22.9% para mujeres mayores de 36 años. Esta probabilidad depende de factores como:
-
- La edad al momento de la extracción de los óvulos. Las mujeres menores de 35 años tienen una mayor probabilidad de éxito que las mujeres mayores.
- El número de óvulos extraídos y conservados. Las mujeres que tienen un mayor número de óvulos recolectados tienen una mayor probabilidad.
Eficacia de la criopreservación de embriones. La eficacia de los procedimientos de criopreservación de embriones se puede medir de acuerdo con el número de bebés nacidos tras el proceso de recuperación e implantación de los embriones criopreservados. La posibilidad de tener un bebé, después de un procedimiento de criopreservación de embriones es del 40-45% para las mujeres menores de 35 años y del 20-23% para las mujeres mayores de 36 años. Es importante tener en cuenta que llegar a tener un bebé después de un procedimiento de criopreservación de embriones depende de varios factores entre los que destacan:
-
- La edad de la mujer en el momento de la extracción de los óvulos.
- El número de ovocitos extraídos y conservados.
- La calidad de los espermatozoides.
- La cantidad y calidad de embriones que se logren criopreservar.
Seguridad de los procedimientos de PF
Seguridad de los procedimientos de PF: Los datos sobre la seguridad de las técnicas de PF en mujeres con cáncer de mama se ven limitados por el carácter observacional de los estudios que la evalúan.
1. Recurrencia. La evidencia disponible actualmente muestra que la estimulación ovárica controlada con la administración conjunta de letrozol para la criopreservación de ovocitos o embriones no aumenta el riesgo de recurrencia del cáncer de mama.
2. Mortalidad. La evidencia disponible actualmente muestra que la estimulación ovárica controlada para la criopreservación de ovocitos o embriones no aumenta el riesgo de mortalidad.
3. Complicaciones y efectos adversos. Un posible efecto adverso de la estimulación ovárica es el síndrome de la hiperestimulación ovárica (SHO) que ocurre entre un 0,6-10%. El hecho de ¨forzar¨ al ovario a producir muchos óvulos (recordemos que en situaciones normales se suele producir un único óvulo por ciclo menstrual) puede hacer que se presente un cuadro leve con náuseas, vómitos, diarrea, aumento de peso, hinchazón y dolor abdominal.
Si el síndrome es grave, se puede acompañar de hemoconcentración (aumento de la concentración de la sangre circulante caracterizada por el aumento de su peso específico, de la tasa de proteínas, de su viscosidad y del número de glóbulos rojos), hipoperfusión de los órganos (disminución del flujo de sangre que pasa por un órgano) y aumento de riesgo de tromboembolismo, con aparición de síntomas como hipotensión, taquicardia, derrame pleural, dificultad respiratoria, trastornos hematológicos y alteración de las funciones renal y hepática.
El SHO se produce, generalmente, por desencadenar la ovulación mediante el uso de una hormona conocida como gonadotropina coriónica humana (hCG). En pacientes con cáncer de mama, para desencadenar la ovulación tras la hiperestimulación ovárica minimizando el riesgo de desarrollar SHO, siempre deben usarse, en lugar de hCG, agonistas de la hormona liberadora de gonadotropinas (aGnRH).
Por otro lado, pueden darse complicaciones relacionadas con la extracción de óvulos, como dolor pélvico y abdominal leve, infecciones, hemorragias, hematomas y lesiones ováricas. Asimismo, es posible que aparezcan complicaciones emocionales.
Es importante ser consciente de que someterse a un tratamiento de preservación de la fertilidad no garantiza un embarazo. Ante la dificultad de quedarse embarazada tras la criopreservación de embriones, es posible que algunas personas manifiesten síntomas como ansiedad, depresión o frustración.
Por último, pueden aparecer una serie de complicaciones relacionadas con la transferencia de los embriones en el útero de la mujer: Algunas personas pueden sentir molestias leves al pasar el catéter a través del cuello del útero, tener sangrados leves tras el procedimiento o desarrollar infecciones que pueden tratarse con facilidad mediante el uso de antibióticos.
- 2.2.2 Métodos aún en investigación y líneas de investigación futura
- - Criopreservación de tejido ovárico
- - Quimioprofilaxis
- - Maduración de ovocitos in vitro
- - Cuadro resumen de las características de los procedimientos
Métodos aún en investigación y líneas de investigación futura
Además de la criopreservación de ovocitos y embriones, consideradas técnicas de preservación de la fertilidad bien establecidas para su uso en mujeres con cáncer de mama, existen otras técnicas que muestran resultados prometedores, pero que todavía requieren de mayor investigación para la recomendación de su uso. A continuación, se describen las principales características de algunas de estas técnicas.
Criopreservación de tejido ovárico
La criopreservación de tejido ovárico consiste en la extracción, mediante cirugía, del tejido ovárico (corteza ovárica u ovario completo), antes de la administración del tratamiento oncológico, para su congelación durante un tiempo indefinido y su posterior autotrasplante una vez finalizado el tratamiento oncológico en caso de fallo ovárico o infertilidad.
Se trata de un procedimiento que tiene la ventaja de no requerir estimulación ovárica, por lo que puede ser llevado a cabo de forma inmediata, además, a diferencia de la criopreservación de ovocitos o embriones, no requiere madurez sexual, por lo que es el método de elección en niñas.
No obstante, todavía se considera una técnica experimental que requiere de mayor investigación, por el riesgo de reintroducir células tumorales con el re-injerto. Aunque si bien es cierto, ya se han reportado bebés nacidos con el uso de esta técnica.
Quimioprofilaxis
La quimioprofilaxis consiste en la supresión temporal de la función ovárica mediante la administración de agonistas de la hormona liberadora de gonadotropina (aGnRH), como forma más frecuente, justo antes de iniciar el tratamiento de quimioterapia y durante todo el tiempo que ésta dure.
Es decir, esta técnica lo que pretende es dejar “congelada” la función ovárica, de manera que los tratamientos quimioterápicos no sean tan agresivos en un ovario “congelado funcionalmente” y así cuando se acaba el tratamiento, se “despierte” al ovario para que empiece a funcionar, a producir óvulos de manera natural.
La Sociedad Americana de Oncología Clínica, en su última guía, recomienda el uso de GnRH en mujeres jóvenes con cáncer de mama cuando otros métodos como la criopreservación de óvulos, embriones o tejido ovárico, no son factibles.
Maduración de ovocitos in vitro
La técnica de maduración de ovocitos in vitro consiste en la extracción de ovocitos inmaduros para su posterior cultivo en un medio apropiado hasta su maduración. Una ventaja de este procedimiento es que, al no requerir estimulación ovárica o únicamente un protocolo muy leve, los ovocitos se pueden extraer en cualquier momento del ciclo menstrual.
De esta manera, la maduración de ovocitos in vitro podría ser una alternativa a considerar en aquellas mujeres en las que sea necesario evitar la estimulación ovárica, así como en pacientes con tumores hormono-dependientes en las que se desaconseja el empleo de la estimulación convencional y en aquellos casos en los que sea urgente iniciar el tratamiento oncológico.
Sin embargo, hasta el momento, en la literatura no se ha establecido la seguridad del procedimiento, por lo que la maduración de ovocitos in vitro continúa considerándose una técnica experimental.
Cuadro resumen de características de los procedimientos
| Nivel de evidencia | Método | En qué consiste | Ventajas | Inconvenientes |
| Métodos bien establecidos | Criopreservación de óvulos maduros | Consiste en la conservación de los óvulos no fertilizados a muy bajas temperaturas para su conservación con el fin de mantener intactas sus propiedades hasta el momento de la descogelación y conservar el potencial reproductivo de la mujer | Técnica bien establecida
Posibilidad de diagnóstico genético preimplantacional No requiere esperma (pareja / donante) |
Requiere estimulación ovárica
Retrasa el inico del tratamiento oncológico aproximadamente dos semanas |
| Criopreservación de óvulos maduros | Permite congelar óvulos fecundados a muy baja temperatura (-196º) para que puedan ser almacenados y conservados durante tiempo sin alterar su viabilidad. Implica la existencia de pareja o donante masculino | Técnica bien establecida
Posibilidad de diagnóstico genético preimplantacional |
Requiere estimulación ovárica
Retrasa el inico del tratamiento oncológico aproximadamente dos semanas Requiere esperma (pareja / donante) Problemas éticos / legales |
|
| Métodos aún en desarrollo | Criopreservación del tejido ovárico | Consiste en la extracción, mediante cirugía o laparoscopia, de tejido ovárico (corteza ovárica u ovario completo), antes de la administración del tratamiento oncológico, para su congelación durante un tiempo definido y su posterior autotrasplante una vez finalizado el tratamientooncológico en caso de fallo ovárico o infertilidad. | No requiere estimulación ovárica
Método independiente del ciclo mestrual No retrasa el inicio del tratamiento oncológico |
Método experimental
Requiere cirugía o laparoscopia Posible riesgo de recurrencia del cáncer por el riesgo de reimplantar células tumorales con el injerto |
| Maduración de óvulos in vitro | Consiste en la extracción de óvulos inmaduros para su posterior cultivo en un medio apropiado hasta su maduración | No requiere estimulación ovárica
Método independiente del ciclo menstrual |
Método experimental
Tasas de éxito limitadas |
|
| Quimioprofilaxis (GnRH) | Consiste en la supresión temporal de la función ovárica mediante la administración de agonistas de la hormona liberadora de gonadotropina (aGnRH) justo antes de iniciar el tratamiento de quimiotrapia y durante todo el tiempo que ésta dure. | Técnica no invasiva
REcuperación de la función ovárica espontánea |
Método experimental
Escasez de datos sobre la eficacia en la restauración de la fertilidad |
Aspectos psicológicos
La toma de decisiones respecto a los procedimientos debe plantearse justo en el momento del diagnóstico. Hay que considerar que en momentos previos al inicio de los tratamientos de quimioterapia puede ser difícil y complejo tanto para los profesionales sanitarios como para las mujeres con cáncer de mama tomar cualquier decisión respecto a la PF ya que en la toma de esas decisiones confluyen aspectos médicos, bioéticos, jurídicos y psicológicos, en la que ambos están implicados.
Además, es una de las primeras decisiones que deben tomar las mujeres jóvenes, que afectan su futuro como mujeres y futuras madres. Por lo tanto, uno de los aspectos que puede ayudar es que las mujeres den a conocer sus necesidades, valores y preferencias relacionadas con la maternidad. Dado que generalmente en este primer momento de conocimiento de la existencia de un cáncer la mayoría de las pacientes (y sus familiares, que tienen una influencia sobre ellas bastante importante) se encuentran en una situación de bloqueo emocional, es fundamental la comunicación y el apoyo ofrecido por los profesionales sanitarios.
Es importante tener en cuenta que desear tener hijos/as y tener dificultades para poder alcanzar ese deseo puede ser una fuente potencial de sentimientos y emociones negativas. Algunas mujeres, fruto de la incertidumbre y la imposibilidad de prever si finalmente conseguirán el embarazo, pueden manifestar síntomas de ansiedad, como agitación, dificultad para respirar o sensación de debilidad, entre otros.
Asimismo, algunas mujeres con dificultades reproductivas pueden manifestar síntomas de depresión y sensación de falta de sentido vital. En este sentido, es recomendable que las personas que estén pasando por un procedimiento de preservación de la fertilidad pongan en marcha también otros proyectos vitales que les ilusionen. Es importante ser consciente de que ni los tratamientos de preservación de la fertilidad ni los procedimientos de reproducción asistida, desafortunadamente, no nos aseguran un embarazo.
Algunas recomendaciones para aliviar el impacto psicológico
- Vivir esta experiencia acompañada. Aunque no siempre puedan acudir a consulta con un familiar, lo ideal es sentir y saber que cuenta con apoyo.
- Pedir ayuda cuando lo consideren necesario. Los psicólogos son muy útiles en estos momentos y le podrán proveer de herramientas para ayudarles a sobrellevar las situaciones más difíciles.
- Preguntar todas las dudas que tenga en el momento de la toma decisiones sobre los procedimientos de PF y durante todo el proceso. Es importante poder expresarle al profesional sanitario, o a cualquier miembro del equipo, lo que sienten, así como las preocupaciones que tienen.
- Es fundamental tener otros proyectos en marcha, además del de ser madres. Centrarse en un único objetivo que no dependa totalmente de uno mismo, no resulta beneficioso, sobre todo cuando no se sabe cuándo se logrará ese objetivo.
- No vivir el tratamiento como la última opción para ser madre, sino como un tratamiento que se espera salga bien, pero que no representa la última opción.
Recuerde que puede pedir ayuda cuando lo considere necesario. Los profesionales de la psicología están para ayudarle en estos momentos y proporcionarle herramientas para sobrellevar mejor las situaciones complicadas que puedan presentarse.
- Experiencias de pacientes
- Impacto del cáncer de mama en la fertilidad
- ¿Cuáles son las opciones de PF si tienes CM?
- Tomar la decisión de preservar o no la fertilidad
- ¿Cómo ha sido el proceso seguido la preservación de la fertilidad?
- Recomendaciones a otras mujeres con CM
- Referencias
Experiencias de pacientes
En este apartado encontrará las experiencias de un grupo de mujeres con cáncer de mama de diferentes regiones de España. Se trata de mujeres que han tenido esta enfermedad en edad fértil, entre los 30 y 45 años, y quienes han compartido sus vivencias a través de las entrevistas realizadas por nuestro equipo de investigación. Estas vivencias son recogidas en un estudio llamado: Experiencias de mujeres con cáncer de mama sobre la preservación de la fertilidad. A través de las entrevistas las mujeres nos cuentan cómo tuvieron acceso a la información sobre preservación de la fertilidad por primera vez, y cómo se dio en su caso la toma de decisiones de realizar o no un procedimiento de preservación. Cuentan los aspectos que fueron importantes para ellas en el momento de tomar esa decisión, así como las posibles barreras que se encontraron para acceder a estos servicios. Además, las mujeres relatan sus experiencias a lo largo de los procedimientos de preservación de la fertilidad, así como formulan algunas recomendaciones, fruto de su experiencia, para las mujeres que les diagnostican un cáncer de mama y les preocupa el tema de su fertilidad. Esperamos que esta información pueda servir de apoyo para mujeres que pasen por una situación similar, sus familiares o amigos, para su autocuidado y la toma de decisiones. Es importante mencionar que las experiencias de las mujeres con cáncer de mama recogidos en este apartado, en ningún caso sustituye la información médica sobre tratamientos o cuestiones clínicas. Para cualquier duda o aclaración es necesario consultar sobre ello a su profesional sanitario.
Toda la información que encuentra en este apartado procede de una investigación cualitativa desarrollada por el equipo interdisciplinar de especialistas en ciencias sociales y biomédicas del Servicio de Evaluación del Servicio Canario de la Salud (Equipo de investigación de PyDeSalud) y ha sido supervisada por un Comité Científico de Expertos en cáncer de mama y preservación de la fertilidad. El equipo de investigación agradece el apoyo que ha recibido de diferentes instituciones para la elaboración de este estudio y, especialmente, a las mujeres entrevistadas.
Impacto del cáncer de mama en la fertilidad
Ser diagnosticada con un cáncer de mama puede ser abrumador ya que conlleva importantes efectos físicos y psicológicos. La manera de hacer frente a esta enfermedad, a los tratamientos y a los efectos secundarios derivados de estos, puede variar de una persona a otra, aunque de manera frecuente, se ha visto que las personas diagnosticadas sienten que su vida se queda detenida y que se alteran sus prioridades vitales. Algunos de los efectos adversos asociados a los tratamientos oncológicos están relacionados con la fertilidad, la cual puede determinar la vida presente y futura de las mujeres con cáncer de mama en edad fértil y sus familias. Los efectos de los tratamientos contra el cáncer en la fertilidad de las mujeres dependen, entre otros factores, de la edad, la reserva ovárica en el momento del diagnóstico de cáncer, así como del tipo de cáncer y el tipo de tratamiento que se haya seguido. Por tanto, es difícil saber con certeza cómo se verá afectada la fertilidad de las mujeres, Incluso es posible que no todas las mujeres que reciben tratamiento contra el cáncer desarrollen un problema de fertilidad en el futuro.
¿Cuáles son las opciones de PF si tienes CM?
Los tratamientos contra el cáncer pueden afectar la fertilidad y las posibilidades que tiene una mujer de quedarse embarazada en el futuro. La probabilidad de tener problemas de fertilidad debido al tratamiento contra el cáncer depende de muchos factores, entre ellos, la edad, la reserva ovárica, el tipo de cáncer y el tipo de tratamiento contra el cáncer que recibe.
Las opciones que tienen las mujeres con cáncer de mama en relación a la fertilidad son:
- No seguir un tratamiento de preservación de la fertilidad, sino empezar el tratamiento oncológico e intentar quedarse embarazada de manera natural, lo que se conoce como seguir una espera vigilada, ya que no todas las mujeres con un diagnóstico de CM quieren o pueden acceder a un procedimiento de preservación de la fertilidad antes del inicio del tratamiento oncológico. Entre las mujeres que podrían optar por esta opción están:
- Mujeres que prefieren seguir una espera vigilada de su fertilidad y ver si ésta regresa naturalmente después del tratamiento contra el cáncer.
- Mujeres con o sin hijos que consideran que ya tienen su familia establecida.
- Mujeres que están seguras de que no desean tener un embarazo después del tratamiento del cáncer.
- Mujeres que prefieren no acceder a procedimientos de preservación de la fertilidad por cuestiones culturales, religiosas, familiares o personales.
- Seguir un método de preservación de la fertilidad bien establecido, como:
- Criopreservación de ovocitos maduros: Se pueden beneficiar de este tratamiento aquellas mujeres que ya hayan tenido su primera menstruación (postpuberales); tengan buen estado de salud para someterse a una estimulación ovárica; tengan la posibilidad de demorar el inicio del tratamiento oncológico alrededor de dos semanas; tengan una buena reserva ovárica.
- Criopreservación de embriones: Se pueden beneficiar de este método aquellas mujeres que cumplan con los criterios anteriores y que además tengan la posibilidad de acceder a gametos masculinos (de pareja o donante).
- Explorar con los profesionales sanitarios a cargo de su caso, otros métodos de PF no consolidados, y que requieren más investigación, como:
- Criopreservación de tejido ovárico
- Quimioprofilaxis
- Maduración de óvulos in vitro
Estas opciones, aunque requieren más investigación, pueden valorarse cuando:
- Se trata de mujeres en edad fértil con cáncer de mama cuando otros métodos como la criopreservación de óvulos o embriones no son factibles.
Para ayudar a la toma de decisiones sobre estas opciones hemos desarrollado una herramienta que reúne los datos científicos disponibles sobre cada una de ellas y puedes consultar en este enlace.
Tomar la decisión de preservar o no la fertilidad
El proceso de toma de decisiones en relación a la preservación de la fertilidad en la mayoría de los casos ocurre en un contexto de gran urgencia por la necesidad de iniciar los tratamientos oncológicos contra el CM, lo que puede añadir ansiedad y angustia en las mujeres. Los ginecólogos y los oncólogos suelen ser quienes, en primer lugar, explican a las mujeres con cáncer, las opciones de preservación de la fertilidad que se puede seguir de acuerdo a su tipo de cáncer, ya que no todos los tratamientos oncológicos afectan la fertilidad de la misma manera. En la tabla 1 puede verse si los tratamientos oncológicos seguidos en el cáncer de mama, van a afectar la fertilidad
Tabla 1. Efecto de los tratamientos oncológicos sobre la fertilidad
| Tratamientos | ¿Afectará este tratamiento a mi fertilidad? |
| Quimioterapia | Posiblemente. La ciclofosfamida es un medicamento que puede afectar su fertilidad. Por lo general, se administra en combinación con otros medicamentos durante la quimioterapia. |
| Radiación | No. A menos que la radiación afecte la zona de los ovarios, lo cual afectaría su fertilidad. |
| Cirugía | No. A menos que sea necesario someterse a una cirugía para extraerle los ovarios, lo cual afectaría su fertilidad. |
| Terapia hormonal | Posiblemente. Si su cáncer es sensible a las hormonas, podría estar tomando hormonas durante 5 años o más. Esto retrasará su capacidad de quedar embarazada, ya que no es recomendable quedarse embarazada durante este tratamiento. |
| Anticuerpos monoclonales | Se desconoce. En este caso puede estar tomando Trastuzumab durante aproximadamente 1 año. No hay información concluyente sobre el impacto de este medicamento en la capacidad reproductora. |
Luego el grupo de profesionales a cargo de cada caso (oncólogos y ginecólogos) deben evaluar las condiciones generales de las mujeres con CM para dedicar una ventana de tiempo (aproximadamente de dos semanas) para que se lleven a cabo los procedimientos de preservación de la fertilidad. Luego, son las mujeres con CM quienes toman la decisión final de seguir adelante con los procedimientos de PF, basándose en sus intereses y motivaciones personales.
Las mujeres con CM entrevistadas en este módulo han tomado la decisión de seguir o no con un procedimiento de preservación de la fertilidad, previo al inicio de su tratamiento oncológico, por razones tan diversas como pueden ser: el miedo por el riesgo de complicación de su enfermedad, tener un motivo de esperanza para el futuro, la edad en la que podría darse ese posible embarazo y su idea o proyecto de maternidad.
¿Cómo ha sido el proceso seguido en los procedimientos de preservación de la fertilidad?
En un procedimiento de preservación de la fertilidad, ya sea a través de criopreservación de óvulos maduros o de congelación de embriones, se siguen las siguientes fases del proceso:
- Determinación de la reserva ovárica: Para determinar la cantidad y calidad de los óvulos es necesario realizar estudios hormonales y ecografías del ovario.
- Estimulación ovárica controlada: Generalmente se produce un único óvulo por ciclo menstrual; con la estimulación ovárica controlada se pretende conseguir mayor número de óvulos maduros disponibles en un solo ciclo ovárico. La duración de la estimulación ovárica depende de muchos factores, en especial del momento del ciclo en que se encuentre la paciente y de la respuesta a la medicación hormonal. La respuesta dependerá fundamentalmente de la reserva ovárica y de la dosis. Con los protocolos habituales con los que se inicia la estimulación en cualquier momento del ciclo, la estimulación ovárica suele tardar unas dos semanas.
- Punción ovárica para la extracción de los óvulos: La aspiración de los óvulos maduros se practica bajo sedación por vía vaginal, es un procedimiento ambulatorio que no requiere ingreso alguno.
- Fecundación in vitro o inyección intracitoplasmática de espermatozoides (Sólo si se va a realizar congelación de embriones). Esta unión puede hacerse principalmente siguiendo dos procedimientos: la fecundación in vitro tradicional (FIV), en la que se colocan en la misma placa de cultivo los óvulos y los espermatozoides esperando que éstos penetren en el óvulo, o bien mediante inyección intracitoplasmática (ICSI), en la que el espermatozoide se inyecta dentro del óvulo.
- Congelación (de óvulos o de embriones). Actualmente se usa el procedimiento de vitrificación ya que ofrece mejores resultados.
- Descongelación o desvitrificación: En el momento en que se desee proceder a la transferencia de los embriones al útero de la futura madre, se llevará a cabo su descongelación o desvitrificación, la cual consiste en el proceso inverso a la congelación o vitrificación.
- Inyección intracitoplasmática de espermatozoides (Sólo si se ha optado por criopreservar óvulos y este paso no se ha cumplido antes). En este punto se procede a la fusión de gametos, uniendo el óvulo y el espermatozoide, es decir, a la fecundación del óvulo
- Transferencia de embriones: Consiste en la colocación de los embriones en el fondo del útero materno mediante un catéter fino que se introduce por vía vaginal. Para asegurar la colocación de los embriones en el lugar adecuado, se hace de manera eco-guiada (guiada por ecógrafo). Se trata de un proceso que dura unos pocos minutos y que generalmente no requiere sedación.
Si desea más información sobre cada una de estas fases puede acudir a la sección fases del proceso de la herramienta de CM y PF.
En este apartado las mujeres entrevistadas relatan sus experiencias en las primeras fases del proceso relacionadas con la determinación de la reserva ovárica, la estimulación controlada, la extracción y criopreservación de ovocitos. Por el momento, no son demasiadas las mujeres en España que han utilizado los óvulos o embriones crio-conservados tras el diagnóstico de cáncer de mama y han tenido hijos con este procedimiento. Durante esta investigación no pudimos entrevistar a ninguna de ellas, pero sí recogimos cómo vivieron muchas mujeres los primeros pasos del proceso de preservación de la fertilidad y los dilemas a los que se enfrentan las mujeres que han preservado su fertilidad ante la decisión de usar o no lo preservado.
Recomendaciones a otras mujeres con cáncer de mama deberían tener en cuenta
Algunas de las mujeres con CM entrevistadas reflexionan sobre la importancia de que sean las mismas mujeres quienes tomen la iniciativa de pedir información sobre la PF en aquellos casos en que los oncólogos a cargo de su caso, no lo mencionen al planificar su tratamiento.
Referencias
- Vargas-Hernández VM, Ventura-Quintana V, Tovar RJM. Reserva ovárica posterior al tratamiento oncológico en pacientes con cáncer de mama. Rev Mex Med Repro. 2018;8.9(4):138-148.
- Asensio del Barrio C, Palma Ruiz M. Estudio de la efectividad y de la seguridad de la criopreservación de ovocitos y de tejido ovárico para la preservación de la fertilidad en pacientes oncológicas. Red Española de Agencias de Evaluación de Tecnologías y Prestaciones del SNS. Agencia de Evaluación de Tecnologías Sanitarias (AETS) – Instituto de Salud Carlos III, Ministerio de Ciencia, Innovación y Universidades. Madrid. 2018. Informes de Evaluación de Tecnologías Sanitarias.
- Oktay, K., Harvey, B. E., Partridge, A. H., Quinn, G. P., Reinecke, J., Taylor, H. S., … & Loren, A. W. (2018). Fertility preservation in patients with cancer: ASCO clinical practice guideline update. J Clin Oncol, 36(19), 1994-2001.
- Coscia, A. N., Miguens, M. B., Carro, M. M., Nodar, F., & Papier, S. D. (2019). Estimulación ovárica controlada de inicio aleatorio en pacientes con patología oncológica. Reproducción, 34(1), 21-27.
- Acosta-Bueno, C., Cejudo-Román, A., Salazar-Vera, A., & Quiroga-Gil, R. (2020). Estrategias de mejora de la fertilidad: preservación, rejuvenecimiento y células madre. Medicina Reproductiva y Embriología Clínica.
- Curiel B, Prieto MA, Muñoz J and Banderas E. Severe ovarian hyperstimulation syndrome. Med Clin (Barc). 2011;137:184-187.
- Rodgers, R. J., Reid, G. D., Koch, J., Deans, R., Ledger, W. L., Friedlander, M., … & Abbott, J. A. (2017). The safety and efficacy of controlled ovarian hyperstimulation for fertility preservation in women with early breast cancer: a systematic review. Human Reproduction, 32(5), 1033-1045.
- Moravek, M. B., Confino, R., Smith, K. N., Kazer, R. R., Klock, S. C., Lawson, A. K., Gradishar, W. J., & Pavone, M. E. (2018). Long-term outcomes in cancer patients who did or did not pursue fertility preservation. Fertility and sterility, 109(2), 349–355. https://doi.org/10.1016/j.fertnstert.2017.10.029
- Rodriguez-Wallberg, K. A., Eloranta, S., Krawiec, K., Lissmats, A., Bergh, J., & Liljegren, A. (2018). Safety of fertility preservation in breast cancer patients in a register-based matched cohort study. Breast cancer research and treatment, 167(3), 761-769.
- Pérez, M. F., Monzó, M. A., Castilla, J. A., Ballesteros, B. A., Alonso, Z. J., & Barrenetxea, Z. G. Saber más sobre fertilidad y reproducción asistida. España: Sociedad Española de Fertilidad; 2012.
- Acosta-Bueno, C., Cejudo-Román, A., Salazar-Vera, A., & Quiroga-Gil, R. (2020). Estrategias de mejora de la fertilidad: preservación, rejuvenecimiento y células madre. Medicina Reproductiva y Embriología Clínica.
- Vuković P, Kasum M, Raguž J. y cols. Fertility preservation in young women with early-stage breast cancer. Acta Clin Croat. 2019;58(1):147-156. doi:10.20471/acc.2019.58.01.19
- Cobo A, García-Velasco JA, Coello A, Domingo J, Pellicer A, & Remohí J. Oocyte vitrification as an efficient option for elective fertility preservation. Fertil Steril. 2016;105(3):755-64.e8. doi: 10.1016/j.fertnstert.2015.11.027
- Paraíso, B., Parra, L., Reus, R., Gómez de Segura, R., & Sotelo, V. (2020). Síndrome de hiperestimulación ovárica: ¿Qué es y cómo se cura? https://www.reproduccionasistida.org/sindrome-de-hiperestimulacion-ovarica-sho
- Gerstl B, Sullivan E, Ives A, Saunders C, Wand H, & Anazodo A. Pregnancy Outcomes After a Breast Cancer Diagnosis: A Systematic Review and Meta-analysis. Clin Breast Cancer. 2018;18(1):e79-e88. doi: 10.1016/j.clbc.2017.06.016
Toma de decisiones
Las Herramientas de Ayuda son materiales (cuadernillos, folletos, videos, páginas web) con información fiable (basada en estudios científicos) sobre una determinada condición de salud.
Las Herramientas de Ayuda sirven para informar a las personas y así sean capaces de tomar decisiones sobre su salud, teniendo en cuenta sus valores y preferencias. Asimismo, facilitan la relación de las personas afectadas junto a los profesionales sanitarios que las asisten, facilitando el proceso de toma de decisiones conjunta.
¿Por qué se desarrollan las Herramientas de Ayuda?
– Muchas condiciones de salud cuentan con distintas opciones de tratamiento, cada una con diferentes beneficios y efectos adversos, que no afectan ni importan a todas las personas de la misma manera.
– Por otro lado, en las condiciones en las que no existe una única o “mejor” opción de tratamiento, es necesario informar acerca de las distintas opciones e incorporar las preferencias de la persona afectada para que tome decisiones junto con los profesionales sanitarios que las asisten.
Aunque el cáncer de mama es una enfermedad que se da en mujeres y hombres, esta herramienta de ayuda está dirigida a mujeres diagnosticadas de cáncer de mama en edad fértil que podrían iniciar algún procedimiento de preservación de la fertilidad.
Esta Herramienta de Ayuda no describe ni explica exhaustivamente los distintos tratamientos para el cáncer de mama, sino que se centra en los procedimientos de preservación de la fertilidad en mujeres con cáncer de mama. Esta herramienta NO está dirigida a mujeres con cáncer de mama que no estén en edad fértil y que no vayan a iniciar un tratamiento oncológico.
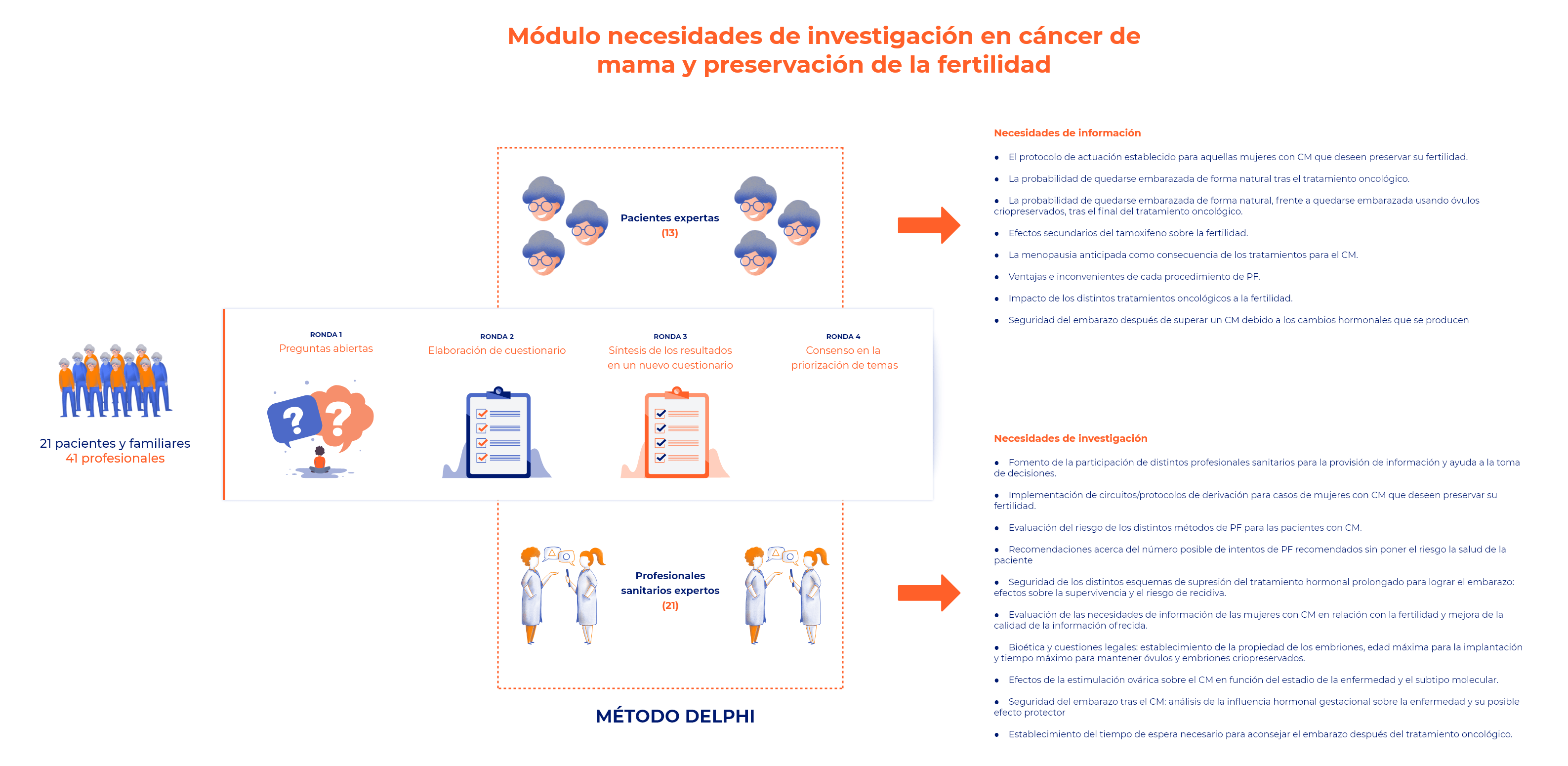
Necesidades y prioridades de información e investigación en preservación de la fertilidad
Las mujeres con cáncer de mama (CM) en edad fértil que hayan decidido someterse o no a un procedimiento de preservación de la fertilidad (PF), así como sus profesionales sanitarios, pueden identificar determinadas áreas en las cuales se requiere más información e investigación, ya sea para la mejora de la atención sanitaria o para aspectos relacionados con la calidad de vida de las pacientes.
Este apartado se ha desarrollado gracias a la colaboración de un grupo de mujeres con cáncer de mama y sus familiares de diferentes regiones de España y de profesionales sanitarios de los servicios de: ginecología, oncología, radioterapia y psico-oncología, quienes han participado voluntariamente en dos estudios Delphi de 3 rondas (definidos previamente en el módulo de cáncer de mama).
Necesidades y prioridades de información e investigación en preservación de la fertilidad
En el primer estudio de consenso Delphi, participaron un grupo mujeres con CM y sus familiares con el objetivo de identificar qué necesidades de información percibían en el ámbito de la preservación de la fertilidad. En la primera ronda se les planteó una pregunta abierta con el fin de que formularán las necesidades de información que percibían. En la segunda y tercera ronda de este estudio se les pidió que puntuaran en una escala de 1 a 10 aquellos temas que consideraron que necesitaban más información. Finalmente, se formuló un listado de temas priorizados con aquellas necesidades de información donde el nivel de consenso fue mayor.
En el segundo estudio participaron un grupo de profesionales sanitarios con el objetivo de identificar aquellos temas dentro del ámbito del cáncer de mama y la preservación de la fertilidad que deberían ser incluidos en la investigación futura. En la primera ronda, se les planteó una pregunta abierta para que formularán las necesidades de investigación que ellos identificaban. En la segunda y tercera ronda del estudio se les pidió que puntuaran en una escala de 1 a 10 aquellos temas que consideraban más relevantes para ser abordados por la investigación. Finalmente, se formuló un listado priorizado de necesidades de investigación en las cuales el nivel de consenso fue mayor.
En ambos estudios los participantes firmaron un consentimiento de participación y recibieron los cuestionarios del estudio por correo electrónico. En todos los casos se preservó el anonimato de los participantes.
En la infografía a continuación se observa el proceso seguido en estos estudios y las necesidades de información y de investigación con mayor consenso entre los participantes y entre los profesionales sanitarios.
- 7.1 Esquema del acceso a las opciones de preservación de la fertilidad
- 7.2 Esquema de proceso de preservación de la fertilidad
- 7.3 Listado de preguntas para tu profesional sanitario
- 7.4 Enlaces de interés
- 7.5 Glosario de términos
- 7.6 Referencias bibliográficas
Esquema de proceso de preservación de la fertilidad
PROXIMAMENTE
Listado de preguntas para tu profesional sanitario
A continuación, te ofrecemos un listado de preguntas que te pueden ayudar a preparar mejor la consulta con el profesional sanitario antes de tomar la decisión sobre los tratamientos de preservación de la fertilidad.
- Actualmente no estoy en una relación de pareja, pero en el futuro me gustaría tener un hijo /a ¿Cuáles son mis opciones?
- ¿Cuánto tiempo es necesario para seguir un procedimiento de preservación de la fertilidad y qué tanto puede retrasar el inicio de mi tratamiento contra el cáncer de mama?
- ¿Tengo posibilidades de tener hijos en el futuro de manera natural?
- ¿Usar alguna opción de preservación de la fertilidad aumentaría la probabilidad de que el cáncer regrese?
- Te ofrecemos algunas preguntas para abordar el tema de tener hijos después de haber recibido un tratamiento contra el cáncer de mama:
- ¿Cómo puedo saber si soy fértil después de haber terminado el tratamiento contra el cáncer de mama?
- Si quedo embarazada después de haber recibido el tratamiento contra el cáncer de mama, ¿tendrá mi hijo una mayor probabilidad de contraer cáncer?
- Si no preservé mi fertilidad antes del tratamiento, ¿todavía tengo opciones de tener hijos?
Enlaces de interés
- Baby Beatles ser madre tras un cáncer (Ver web)
- Sociedad española de fertilidad (Ver web)
- Asociación española contra el cáncer (Ver web)
- Asociación de Mujeres con Cáncer de Mama de Tenerife (Ver web)
- Miriam de la Flor nos habla sobre la preservación de la fertilidad en cáncer de mama (Ver web)
- Ley 14/2006 sobre Técnicas de Reproducción Humana Asistida, cuya última modificación fue realizada en 2015 (Ver web)
- Guía de Práctica Clínicade la Sociedad Americana de Oncología Clínica (ASCO): Fertility preservation in patients with cancer: ASCO clinical practice guideline update (Ver más)
Glosario de términos relacionados con la preservación de la fertilidad
- Alquilante: Tipo de medicamento que se usa para el tratamiento de cáncer. Se intercala dentro del ADN de las células impidiendo que las células cancerosas se reproduzcan.
- Anestesia general: Es una combinación de medicamentos para hacerle dormir, de modo que no esté al tanto de la cirugía y no se mueva ni sienta dolor mientras se realiza.
- Ciclofofasmida: Agente quimioterapéutico utilizado para tratar diferentes tipos de cáncer, incluyendo linfomas, leucemias, mieloma, cáncer de pulmón y cáncer de mama.
- Congelación de embriones: Los embriones se someten a temperaturas bajo cero y así se guardan para su uso futuro.
- Congelación de óvulos: Los óvulos extraídos de la mujer se congelan a temperaturas bajo cero, sin fertilizar, y así se almacenan para su uso posterior. Esto también se conoce como criopreservación de ovocitos maduros.
- Congelación de tejido ovárico: Es un método experimental de preservación de la fertilidad en el que mediante cirugía se extrae un trozo de ovario o bien un trozo de capa externa del ovario, que contiene una gran cantidad de óvulos inmaduros, y se congela para su uso futuro.
- Cuerpo lúteo: El cuerpo lúteo o cuerpo amarillo es una masa glandular de color amarillo situada en el ovario, que se forma justo después de la ovulación. El cuerpo lúteo secreta progesterona y algo de estrógeno, y si se fertiliza el óvulo, se hace más grande y desprende hormonas para sustentar el embarazo. En caso de que no se produzca la fertilización, degenera y encoge hasta que empieza el siguiente ciclo menstrual.
- Derrame pleural: Es una acumulación de líquido entre las capas de tejido que recubren los pulmones y la cavidad torácica.
- Dispositivo anticonceptivo intrauterino (DIU): dispositivo insertado en el útero para prevenir el embarazo (concepción). El DIU puede tener forma de bobina, triángulo o T y es de plástico o metal.
- Embarazo: Es el estado de llevar un embrión en desarrollo dentro del cuerpo femenino.
- Endometriosis: Es una afección en la que el tejido que funciona como revestimiento del útero (el endometrio) se encuentra fuera del útero.
- Esperma: Es el conjunto de espermatozoides y líquidos varios (tales como el líquido prostático o de las vesículas seminales) que permiten su viabilidad. Los espermatozoides son las células producidas por los órganos reproductores masculinos y que se combinan con el óvulo de la mujer para su fertilización.
- Estimulación ovárica: Es la producción de más de un óvulo por parte de los ovarios femeninos mediante inyecciones de hormonas que aumentan temporalmente la actividad de los ovarios.
- Estimular: Es la acción de aumentar el número de óvulos producidos en el ovario mediante el uso de medicamentos con el fin de incrementar la tasa de embarazo.
- Estradiol: Es una de las principales hormonas femeninas dentro del grupo de los esteroides, relacionada con el patrón de comportamiento de los órganos reproductivos femeninos.
- Fertilidad: Capacidad de engendrar hijos.
- Fertilización in vitro (FIV): Fecundación de un óvulo con un espermatozoide fuera del cuerpo de la mujer en una placa de cultivo.
- Fibromas: Crecimientos no cancerosos que se desarrollan dentro o alrededor del útero.
- Folículos: Pequeñas estructuras llenas de líquido a partir de las cuales se desarrollan los óvulos maduros.
- Gametos masculinos:
- Hemoconcentración: Aumento de la concentración de la sangre circulante caracterizada por el incremento de su peso específico, tasa de proteínas, viscosidad y número de glóbulos rojos.
- HER-2: (factor de crecimiento epidérmico humano, del inglés Human Epidermic Receptor) es una proteína que puede afectar el crecimiento de algunas células cancerosas. Cuando hay niveles altos de la proteína HER-2 en un cáncer de mama, se denomina cáncer de mama HER2 positivo.
- Hipoperfusión: Disminución del flujo de sangre que pasa por un órgano.
- Hipotensión: Tensión sanguínea por debajo de la requerida para un buen funcionamiento del metabolismo.
- Histerectomía: Es el procedimiento quirúrgico para extirpar el útero. Sin útero, la mujer no podrá quedar embarazada, ni tendrá menstruaciones (reglas), independientemente de su edad.
- Hormona liberadora de gonadotropina (GnRH): Hormona liberada por el cerebro que actúa sobre los ovarios activando el ciclo menstrual.
- Infertilidad: No poder quedar embarazada (concebir) de forma natural.
- Letrozol: Medicamento que pertenece al grupo de los inhibidores de la aromatasa y que se utiliza después de la cirugía y otros tratamientos para reducir el riesgo de que el cáncer de mama vuelva. El cáncer de mama estrógeno-dependiente se desarrolla cuando los estrógenos aumentan. Los estrógenos en la mujer derivan de la testosterona, y la enzima que transforma la testosterona en estrógenos es la aromatasa. Al suministrar este medicamento, se inhibe a la aromatasa y como consecuencia no se forman estrógenos con lo cual no pueden volver a activar el cáncer de mama.
- Menopausia: Es el momento en la vida de una mujer cuando finaliza el ciclo menstrual (períodos). Pausia: parada; menos: ciclo menstrual. Parada de los ciclos menstruales.
- Ovarios: Es el órgano reproductor femenino en el que se producen los óvulos.
- Ovocito: Es un término equivalente a óvulo, gameto femenino con finalidad reproductiva.
- Ovulación: Es la liberación del óvulo por parte del ovario. El óvulo liberado por el ovario es recibido por las trompas de Falopio y conducido al útero. Es en las trompas de Falopio donde el óvulo puede ser fecundado por un solo espermatozoide, formándose el futuro embrión que acabará por anidar en el útero.
- Óvulos inmaduros: Nombre de los óvulos que no han crecido ni se han desarrollado a óvulo maduro capaz de ser fecundado por un espermatozoide.
- Óvulos maduros: Células reproductoras femeninas capaces de ser fecundadas por un espermatozoide. A lo largo del ciclo menstrual femenino los óvulos se forman dentro de unos folículos (sacos) donde van madurando hasta generar un óvulo que acabará por ovular. Como norma general se ovula un solo óvulo cada mes. Excepcionalmente se puede ovular más de un óvulo, y si ambos son fecundados tendremos un embarazo gemelar.
- Progesterona: Hormona sexual femenina que segrega el ovario femenino y la placenta, y que tiene la función de preparar el útero para la recepción del óvulo fecundado.
- Pubertad: La edad o el período durante el cual el cuerpo de un niño o niña madura y puede producir espermatozoides u óvulos, respectivamente.
- Radioterapia: Radicaciones X que se dirigen específicamente hacia el foco donde se encuentran las células cancerosas. Los rayos X destruyen las células tumorales.
- Receptores hormonales: Son unas proteínas que se encuentran en las células en general, y sobretodo en las células cancerosas. Si las células cancerosas tienen estas proteínas, el cáncer se denomina “positivo”, y si no los tienen, “negativo”. Las hormonas femeninas estrógenos y progesterona se unen a estas proteínas estimulando el crecimiento del cáncer de mama.
- Recurrencia tumoral: Una vez tratado el cáncer, si éste vuelve a aparecer se denomina recurrente.
- Reserva ovárica: Es la cantidad de óvulos que tiene una mujer en sus ovarios. Las mujeres nacen con un número de óvulos fijo, y a medida que pasan los años este número va disminuyendo. Esta disminución se acelera cuando los ovarios son sometidos a tratamientos de quimioterapia o radioterapia.
- Sarcoma: Tumores cancerosos malignos de los tejidos conectivos.
- Sedación: Es la combinación de medicamentos que ayudan a relajarse y no sentir dolor frente a cualquier procedimiento quirúrgico que se realice.
- Sensible a las hormonas: Un cáncer es sensible a las hormonas (o dependiente de hormonas) cuando en presencia de éstas crece y desarrolla un tumor con posibilidad de que se extienda al resto del cuerpo. La terapia hormonal usa medicamentos que detienen la producción de hormonas o evitan que las hormonas produzcan el crecimiento y expansión de las células cancerosas. Los cánceres que pueden ser sensibles a las hormonas incluyen los cánceres de mama, próstata, útero y riñón.
- Síndrome de ovario poliquístico (SOP): Es cuando el ovario intenta producir un óvulo y no lo consigue. En su intento, diversos folículos que contienen óvulos inmaduros intentan madurar y al menos uno de ellos llegar a ser óvulo maduro, pero ninguno de ellos lo consigue, y por lo tanto estos folículos inmaduros y llenos de líquido desarrollan quistes en el ovario, sin éxito de producir ningún óvulo maduro.
- Sistema reproductor femenino: Son los órganos reproductivos internos de las mujeres, incluidos los ovarios, las trompas de Falopio, el útero y la vagina.
- Subrogación: Es la práctica mediante la cual una mujer que biológicamente no puede tener hijos pide a otra mujer que lo tenga por ella, alquilando así su vientre.
- Supresión ovárica: Es el procedimiento clínico utilizado para evitar que los ovarios produzcan estrógenos, ya sea temporal o permanentemente.
- Tamoxifeno: Es un medicamento que se usa con frecuencia como terapia hormonal para el tratamiento del cáncer de seno en mujeres cuyos tumores son receptores positivos de estrógenos.
- Taquicardia: Trastorno del ritmo cardíaco en el que el corazón late más rápido de lo normal cuando está en reposo (arritmia).
- Terapia hormonal: Tratamiento que sirve para retrasar o detener el crecimiento de ciertos tipos de cáncer (como el cáncer de próstata y de mama). Consiste en la administración de hormonas u otras drogas que bloquean las hormonas naturales del cuerpo.
- Transposición ovárica: Es el procedimiento quirúrgico utilizado para proteger la función ovárica de las radiaciones. Se realiza en pacientes cuyo tratamiento incluye radioterapia pélvica como parte del tratamiento de la enfermedad de Hodgkin y otros cánceres pélvicos.
- Trastorno: En el campo de la medicina, un trastorno es una alteración del funcionamiento normal de la mente o el cuerpo.
- Tromboembolismo: El tromboembolismo venoso (TEV) se refiere a la presencia de un coágulo de sangre anormal que se forma en las venas.
- Trompas de Falopio: Son órganos del sistema reproductor femenino, hay dos trompas de Falopio que transportan el óvulo desde el ovario hasta el útero.
- Útero: Es el órgano en la parte inferior del cuerpo de una mujer donde se da la implantación del óvulo fecundado bajo condiciones óptimas hormonales (presencia de progesterona, entre otros).
- Vitrificación: Es un método de preservación de óvulos, embriones o tejidos mediante congelación rápida a temperaturas muy bajas.
Referencias bibliográficas
- Vargas-Hernández VM, Ventura-Quintana V, Tovar RJM. Reserva ovárica posterior al tratamiento oncológico en pacientes con cáncer de mama. Rev Mex Med Repro. 2018;8.9(4):138-148.
- Asensio del Barrio C, Palma Ruiz M. Estudio de la efectividad y de la seguridad de la criopreservación de ovocitos y de tejido ovárico para la preservación de la fertilidad en pacientes oncológicas. Red Española de Agencias de Evaluación de Tecnologías y Prestaciones del SNS. Agencia de Evaluación de Tecnologías Sanitarias (AETS) – Instituto de Salud Carlos III, Ministerio de Ciencia, Innovación y Universidades. Madrid. 2018. Informes de Evaluación de Tecnologías Sanitarias.
- Oktay, K., Harvey, B. E., Partridge, A. H., Quinn, G. P., Reinecke, J., Taylor, H. S., … & Loren, A. W. (2018). Fertility preservation in patients with cancer: ASCO clinical practice guideline update. J Clin Oncol, 36(19), 1994-2001.
- Coscia, A. N., Miguens, M. B., Carro, M. M., Nodar, F., & Papier, S. D. (2019). Estimulación ovárica controlada de inicio aleatorio en pacientes con patología oncológica. Reproducción, 34(1), 21-27.
- Acosta-Bueno, C., Cejudo-Román, A., Salazar-Vera, A., & Quiroga-Gil, R. (2020). Estrategias de mejora de la fertilidad: preservación, rejuvenecimiento y células madre. Medicina Reproductiva y Embriología Clínica.
- Curiel B, Prieto MA, Muñoz J and Banderas E. Severe ovarian hyperstimulation syndrome. Med Clin (Barc). 2011;137:184-187.
- Rodgers, R. J., Reid, G. D., Koch, J., Deans, R., Ledger, W. L., Friedlander, M., … & Abbott, J. A. (2017). The safety and efficacy of controlled ovarian hyperstimulation for fertility preservation in women with early breast cancer: a systematic review. Human Reproduction, 32(5), 1033-1045.
- Moravek, M. B., Confino, R., Smith, K. N., Kazer, R. R., Klock, S. C., Lawson, A. K., Gradishar, W. J., & Pavone, M. E. (2018). Long-term outcomes in cancer patients who did or did not pursue fertility preservation. Fertility and sterility, 109(2), 349–355. https://doi.org/10.1016/j.fertnstert.2017.10.029
- Rodriguez-Wallberg, K. A., Eloranta, S., Krawiec, K., Lissmats, A., Bergh, J., & Liljegren, A. (2018). Safety of fertility preservation in breast cancer patients in a register-based matched cohort study. Breast cancer research and treatment, 167(3), 761-769.
- Pérez, M. F., Monzó, M. A., Castilla, J. A., Ballesteros, B. A., Alonso, Z. J., & Barrenetxea, Z. G. Saber más sobre fertilidad y reproducción asistida. España: Sociedad Española de Fertilidad; 2012.
- Bedoschi, G., & Oktay, K. (2016). Embryo Cryopreservation in Breast Cancer Patients. In N. Suzuki & J. Donnez (Eds.), Gonadal Tissue Cryopreservation in Fertility Preservation (pp. 39–52). Springer Japan. https://doi.org/10.1007/978-4-431-55963-4_3
- Leonel, E. C. R., Lucci, C. M., & Amorim, C. A. (2019). Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy, 46(3), 173-181.